- Kohlensäure
Kohlensäure (Kohlensäureanhydrid, Kohlendioxyd) CO2 findet sich zu etwa 0,03 Proz. in der Atmosphäre, entströmt in großen Massen tätigen Vulkanen (Südamerika) und an vielen Orten aus Rissen und Spalten des Erdbodens (aus den alten Kratern der Eifel, bei Trier, Brohl, Oberlahnstein, Hönningen, Pyrmont [Dunsthöhle], Eyach und Börstingen am Neckar, Sondra in Thüringen, Eger, Vichy, Hautevirm, Neapel [Hundsgrotte], Java [Tal des Todes], Mofetten in Italien). Quellwasser verdankt gelöster K. seinen erfrischenden Geschmack, und die sogen. Säuerlinge sind sehr reich an K. Kohlensäuresalze (Karbonate) bilden einen Hauptbestandteil der Erdrinde, namentlich der kohlensaure Kalk (Kalkstein, Marmor, Kreide) setzt ganze Gebirge zusammen. Andre natürlich vorkommende Karbonate sind Dolomit CaCO3+MgCO3, Magnesit MgCO3, Witherit BaCO3, Strontianit SrCO3, Spateisenstein FeCO3, Zinkspat ZnCO3. Viele kohlensaure Salze verlieren ihre K. schon beim Erhitzen (Kalkbrennerei, Zersetzung des Natriumbikarbonats bei der Sodafabrikation), aus andern entwickelt sich K. gasförmig, wenn man sie mit einer stärkern Säure übergießt, und so wird die K. in der Natur frei, wenn Kalkstein durch kieselsäurehaltige Lösungen in Kieselgestein verwandelt wird. K. entsteht bei Verbrennung von reinem Kohlenstoff (Diamant) in Sauerstoff, ganz allgemein aber auch bei Oxydation kohlenstoffhaltiger Verbindungen, z. B. beim Verbrennen von Holz und andern Pflanzenstoffen und bei Behandlung derselben mit Oxydationsmitteln. So werden Stärkemehl, Zucker und viele andre Stoffe, die aus Kohlenstoff, Wasserstoff und Sauerstoff bestehen, beim Erhitzen mit Kupferoxyd oder chromsaurem Blei vollständig zu K. und Wasser oxydiert. Ähnlich entsteht K. bei Hüttenprozessen, bei denen Metalloxyde durch Kohle reduziert werden. Abgestorbene Pflanzen- oder Tierstoffe verwesen, oxydieren sich an feuchter Luft, und das Endprodukt ist K. und Wasser. Gärungs- und Fäulnisprozesse liefern ebenfalls K. (Zuckerlösungen gären auf Zusatz von Hefe, wobei der Zucker in Alkohol und K. zerfällt), und wenn man organische Substanz bei Abschluß der Luft erhitzt (trockne Destillation), so entwickelt sich neben andern (entzündlichen) Gasen auch K. Die K. ist also ganz allgemein Zersetzungsprodukt pflanzlicher und tierischer Stoffe, und da solche im Boden fast niemals fehlen, so bildet sich auch im Boden beständig K. und fehlt in keinem Quellwasser. Wo aber organische Stoffe im Boden massenhaft angehäuft sind, wie in den Steinkohlenflözen, tritt auch K. reichlich auf (Schwere Wetter, Schwaden der Bergleute) und entweicht oft aus dem Boden in Strömen. In die Atmosphäre gelangt auch viel K. durch den Atmungsprozeß der Menschen und Tiere; der eingeatmete Sauerstoff wird im Körper zur Oxydation organischer Stoffe verbraucht, und das Oxydationsprodukt, die K., verläßt den Körper mit der ausgeatmeten Luft. In der Technik entnimmt man K. vielfach den natürlichen Kohlensäurequellen oder Bohrlöchern, diese liefern z. T. sehr reine K., die zur Bleiweißfabrikation etc. direkt benutzbar ist und nach einer Reinigung auch verflüssigt wird. Dem Bohrloch bei Burgbrohl in der Eifel entströmen in einer Stunde 900, dem bei Sondra in Thüringen 1000 cbm K. Hier entströmt das Gas dem Erdboden unter einem Druck von 10 Atmosphären, es enthält 99 Proz. K. und 1 Proz. Stickstoff und ist frei von übelriechenden und übelschmeckenden Bestandteilen. Sehr reiche Gasquellen sind auch die bei Salzungen und bei Herste in Westfalen. Zur Entfernung des Stickstoffs läßt man das Gas unter hohem Druck von Wasser absorbieren, treibt den Stickstoff durch Einleiten reiner Kohlensäure aus (Daltons Gesetz), reinigt die K., wenn nötig, mit übermangansaurem Kali oder Chromsäure und entzieht dann das Gas dem Wasser unter niedrigem Druck. Aus Sprudeln oder Säuerlingen sammelt man die freiwillig sich ausscheidende K., oder man entzieht sie dem Wasser, indem man dies durch einen Heber führt und an dessen etwa 7 m hohem Scheitel die sich ausscheidende K. mit einer Vakuumpumpe absaugt. Auch spritzt man das Wasser in einem Zylinder gegen Koks und saugt die ausgeschiedene K. ab.
Zur Darstellung von K. übergießt man kohlensauren Kalk (Marmor, Kalkstein, Kreide) mit Salzsäure, wobei der Rückstand aus Chlorcalcium besteht, oder kohlensaure Magnesia (Magnesit) mit Schwefelsäure, wobei schwefelsaure Magnesia (Bittersalz) als Nebenprodukt erhalten wird. Um die entwickelte K. zu reinigen, leitet man sie durch Waschgefäße, die Lösungen von schwefelsaurem Eisenoxydul, kohlensaurem Natron, neutralem Eisenchlorid und übermangansaurem Kali enthalten, auch durch gut ausgeglühte Holzkohle. Vorteilhaft kann man auch die K. in kalte Lösung von kohlensaurem Natron (Soda) von etwa 9° B. leiten und die dabei entstehende Lösung von doppeltkohlensaurem Natron erhitzen. Sie gibt dann die absorbierte K. wieder ab und hinterläßt eine Lösung von kohlensaurem Natron, die von neuem verwendet werden kann. Man benutzt zur Darstellung von K. auf diese Weise im kleinen gewöhnlich Gasentwickelungsapparate, aus Glasflasche, Trichterrohr zum Eingießen der Säure und Gasableitungsrohr bestehend, bei fabrikmäßigem Betrieb aber zylindrische kupferne Kessel mit Rührapparat, einem Säuregefäß, aus dem beliebig Säure in das Entwickelungsgefäß abgelassen werden kann, Gasableitungsrohr etc. Viel K. bereitet man durch Verbrennen von Koks. Früher benutzte man hierzu den Kindlerschen Ofen, in dem die heißen Verbrennungsgase zugleich Kalk brannten. Gegenwärtig verbrennt man Koks in einer Feuerung, in der auf einem im Winkel von nahezu 45° geneigten Roste stets eine gleichmäßige, 25–30 cm dicke Schicht des Brennmaterials gebildet wird, oder man benutzt eine Gasfeuerung, bei der in genügend dicker Koksschicht zuerst Kohlenoxyd entsteht, d. is dann durch eine genau regulierte Luftmenge zu K. verbrannt wird. Die Verbrennungsgase enthalten 18–19 Volumprozent K. In Zuckerfabriken bereitet man K. durch Brennen von Kalk in Öfen mit ununterbrochenem Betrieb, die im obern Teil verengert und durch Wasserverschluß verschlossen sind, während ein Rohr unter dem Deckel die K. ableitet. Als Feuerungsmaterial dienen am besten Generatorgase, und eine Saugpumpe bewirkt den Luftzug durch die Feuerung und führt die K. durch die Reinigungsapparate. Kalköfen liefern ein Gas mit 30–32 Volumprozent K., 65 Volumprozent Stickstoff, wenig Sauerstoff und schweflige Säure. Aus den Gasgemischen, die Koksfeuerungen und Kalköfen liefern, kann die K. auf physikalischem oder chemischem Weg abgeschieden werden. Ersterer gründet sich darauf, daß der beigemengte Stickstoff bei der für die fabrikmäßige Kohlensäureverflüssigung üblichen Temperatur und Spannung noch gasförmig ist, und daß K. in Wasser ziemlich bedeutend, die beigemengten Gase aber sehr wenig löslich sind. Die chemische Methode benutzt Flüssigkeiten, welche die K. absorbieren, Soda-, besser Pottaschelösungen. Nach dem Ozoufschen Verfahren erhält man K., indem man kohlensauren Kalk und Koks oder Koks allein in geeigneten Öfen brennt oder verbrennt, mit den entweichenden Gasen erhitzt man zunächst die Kessel (Abtreiber), welche die Bikarbonatlösung enthalten, dann leitet man sie durch Waschtürme, in denen Wasser über Kalksteine rieselt, und durch eine Pottaschelösung, um die letzten Spuren von schwefliger Säure zu entfernen, worauf sie sein verteilt die Absorptionsgefäße durchströmen, die Lösungen von Soda oder Pottasche enthalten. Die mit K. gesättigte Lauge wird in einen Vorwärmer gebracht, in dem sie durch die aus dem Abtreiber fließende Monokarbonatlauge auf etwa 70° gebracht wird, und gelangt dann in den Abtreiber, in dem die Bikarbonatlösung in Monokarbonat und K. zersetzt wird. Die in besondern Apparaten vollständig gekühlte Monokarbonatlauge gelangt wieder in die Absorptionsapparate, die aus den Abtreibern entweichende K. wird durch Abkühlung von Wasser befreit, in einen Gasometer geleitet, in einem mit Chlorcalcium gefüllten Trockenturm vollständig getrocknet und dann durch Holzkohle von Riechstoffen befreit. Statt der Sodalösung benutzt man zur Absorption der K. auch gepulvertes Natriumkarbonat, das bei ausreichender Feuchtigkeit die K. gut absorbiert. Magnesit wird in Retorten gebrannt und liefert sehr reine K. Man hat auch versucht, die Verbrennungsgase von Dampfkesselfeuerungen anzufangen und zu reinigen, doch leidet darunter gewöhnlich der Betrieb des Kessels zu sehr. Für die Benutzung der K. aus gärenden Flüssigkeiten sind mehrere Verfahren ausgearbeitet worden, die darin gipfeln, die K. an Natriumkarbonat zu binden und das Bikarbonat zu zersetzen. Die Schwierigkeiten liegen in den eigenartigen Betriebsverhältnissen der Gärungsgewerbe.
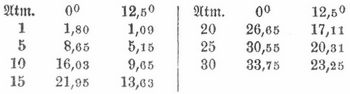
K. ist ein farbloses Gas, riecht und schmeckt säuerlich prickelnd, rötet feuchtes blaues Lackmuspapier, doch verschwindet die Rötung allmählich wieder an der Luft. Sie ist nicht brennbar, und brennende Körper erlöschen in K.; ebensowenig kann K. die Atmung unterhalten, doch ist sie nicht giftig. Eine Kerze erlischt in Luft, die 0,2 Volumen K. enthält. Das spezifische Gewicht der K. ist 1,529 (1 Lit. wiegt bei 0° und 760 mm Druck 1,9712 g), und wegen dieses hohen Gewichts sammelt sich K., die sich in abgeschlossenen Räumen entwickelt, am Boden derselben und kann in Kellern, Brunnen und Höhlungen Erstickungen herbeiführen. Ist die angesammelte Schicht niedrig, so stirbt ein Hund, der den Raum betritt, während ein aufrecht gehender Mensch ungefährdet bleibt (daher der Name der »Hundsgrotte« [s. d.] in Unteritalien). 1 Volumen Wasser absorbiert bei
Alkohol absorbiert bei 0°: 4,44 Vol., bei 20°: 2,98, bei 40°: 2,20 Vol.; auch in Äther ist K. leicht löslich. Die Absorptionsfähigkeit des Wassers für K. nimmt bei erhöhtem Druck zu; Wasser löst Volumen K. bei
Bei einer Temperatur von 0° und einem Druck von 36 Atmosphären (bei gewöhnlicher Temperatur 50–60 Atmosphären) wird K. zu einer Flüssigkeit verdichtet; bei -30° erfolgt die Verdichtung unter einem Druck von 18 Atmosphären; oberhalb 31,35° (kritischer Punkt) läßt sich K. nicht mehr verflüssigen. Flüssige K. findet sich in mikroskopisch kleinen Bläschen in vielen Mineralien (Quarz, Topas, Saphir, Labradorit und in Augit, Olivin, Feldspat von Basalt und Basaltlava). Sie ist farblos, durchsichtig, leicht beweglich, vom spez. Gew. 0,9989 bei -10°, 0,945 bei 0° und 0,9067 bei 7,9°, dehnt sich beim Erwärmen sehr stark aus (stärker als Gas), ist wenig löslich in Wasser, mischbar mit Alkohol, Äther, Terpentinöl und siedet unter einem Druck von 760 mm bei -78°. Die Dampfspannung bei verschiedenen Temperaturen beträgt:
Flüssige K. leitet die Elektrizität schlecht und rötet trocknes Lackmuspapier nicht. Mit Wasser bildet sie mehrere Hydrate. Flüssige K. gerät an freier Luft in heftiges Sieden und erstarrt dabei, da der Siedepunkt der K. bei Atmosphärendruck (-78°) erheblich niedriger liegt als der Schmelzpunkt, zu einer lockern weißen Masse. Die starre K. hat ein spezifisches Gewicht von 1,4, sie verdunstet als schlechter Wärmeleiter viel weniger schnell als die flüssige, gleitet bei leichter Berührung mit dem Finger infolge starker Gasbildung ab, erzeugt, auf die Haut gedrückt, eine Brandblase und Wunde; sie schmilzt im geschlossenen Gefäß bei -57° (-65,5°) und übt bei dieser Temperatur einen Druck von 5 Atmosphären aus, der für jeden Thermometergrad beinahe um eine Atmosphäre steigt. Durch Verdunstung der starren K. an der Luft entsteht eine Temperatur von -78°; ein Brei von starrer K. und Äther ergibt aus noch nicht ganz aufgeklärten Gründen eine noch niedere Temperatur, und wenn man die Verdampfung durch Verminderung des Atmosphärendrucks begünstigt, so sinkt die Temperatur unter -100°. Man benutzt daher die Mischung von starrer K. und Äther als Kältemischung. Bei 1700° zerfällt K. spurenweise in Kohlenoxyd und Sauerstoff, bei 900° wird sie von Wasserstoff noch nicht zersetzt. Rotglühendes Magnesium verbrennt in K. unter Ausscheidung von Kohlenstoff. Auch Kalium, Natrium, Aluminium reduzieren K. unter Ausscheidung von Kohlenstoff, viele andre Metalle und glühende Kohle reduzieren K. nur zu Kohlenoxyd. Leitet man K. über erhitztes Natrium, so entsteht oxalsaures Natron; mit Kalium gibt feuchte K. ameisensaures Kali. Unter dem Einfluß der dunkeln elektrischen Entladung gibt K. mit Wasserstoff Ameisensäure, mit Wasserdampf Ameisensäure und Sauerstoff. Auch platiniertes Magnesium reduziert wässerige K. zu Ameisensäure, Palladiumwasserstoff erzeugt auch Formaldehyd.
K. wird von kohlensauren, stärker von ätzenden Alkalien und Ätzkalk, Ätzbaryt etc., sehr lebhaft von einer lockern Mischung aus gleichen Teilen Ätzkalk und gepulvertem schwefelsaurem Natron absorbiert. Gasförmige und in Wasser gelöste K. gibt mit Kalkwasser einen Niederschlag von kohlensaurem Kalk; ein großer Überschuß von K. löst aber diesen Niederschlag wieder zu doppeltkohlensaurem Kalk, und wenn man diese Lösung an der Luft stehen läßt oder erhitzt, so entweicht die Hälfte der K., und kohlensaurer Kalk scheidet sich aus. Das Gas, das man gewöhnlich K. nennt, ist Kohlensäureanhydrid. Die eigentliche K. H2CO3 ist in der wässerigen Lösung des Kohlensäureanhydrids enthalten, aber nur bei 0° unter einem Druck von mindestens 12,3 Atmosphären beständig. In den Kohlensäureestern muß man vierbasische Orthokohlensäure H4CO4 annehmen.
K. spielt in der Natur eine große Rolle. Sie wird von den Pflanzen aufgenommen und unter dem Einfluß des Lichtes in den chlorophyllhaltigen Zellen gleichzeitig mit Wasser unter Abscheidung von Sauerstoff in organische Substanz verwandelt. Die Pflanzen nehmen also K. auf und geben Sauerstoff ab, die Tiere dagegen atmen umgekehrt Sauerstoff ein und K. aus, und alle von den Pflanzen erzeugte organische Substanz wird durch den Stoffwechsel der Tiere, durch Verbrennung, Fäulnis und Verwesung, wieder in K. und Wasser verwandelt. Der tierische Körper sucht sich der in seiner Blutbahn gebildeten K. möglichst schnell zu entledigen; häuft sich die K. im Blut an, so entsteht sofort Gefahr, und wenn nicht schnell Hilfe geschafft werden kann, erfolgt der Tod. In bestimmter Konzentration eingeatmet, erzeugt K. Stimmritzenkrampf, daher die sofort eintretende Unmöglichkeit, in reiner K. weiter zu atmen. Schon eine Beimengung von 1 Proz. K. zur atmosphärischen Luft verursacht bei längerm Einatmen Unbehagen und Störung der Funktionen des Organismus. Ein Kohlensäuregehalt der eingeatmeten Luft von 20–30° hindert die Abgabe der K. aus dem venösen Blut. Beim Trinken von kohlensäurereichem Wasser scheint der Appetit angeregt zu werden, die Verdauung wird befördert, die Harnabscheidung gesteigert. Bei Einwirkung von K. auf die äußere Haut tritt Gefühl von Wärme und Behaglichkeit auf, Schweiß bricht aus, und bei gesteigerter Einwirkung zeigen sich dieselben Erscheinungen wie beim Einatmen verdünnter K. (Schwindel, Kopfschmerz und rauschartige Bewußtlosigkeit); bei starker lokaler Einwirkung erfolgt zuletzt Anästhesie. Ein Gehalt der Luft von 3–5 Proz. K. kann bei längerer Einatmung derartige Vergiftungserscheinungen herbeiführen, aber in gewissem Grade tritt auch Gewöhnung ein, und beim Einatmen frischer Luft verschwinden die Vergiftungserscheinungen. K. wirkt auch antiseptisch. Man benutzt kohlensäurereiches Wasser (Säuerlinge, künstliche Mineralwässer, Sodawasser) als kühlendes, durstlöschendes Mittel, bei verschiedenen Affektionen des Magens und der Respirationsorgane, äußerlich in Form von Bädern, Duschen gegen Rheumatismus, Lähmungen etc. Das Gas wird gegen chronische Katarrhe eingeatmet und äußerlich bei Krankheiten der weiblichen Geschlechtsorgane, bei alten Geschwüren etc. benutzt; auch ist es als anästhetisches Mittel empfohlen worden. In der Technik dient K. zur Darstellung von Bleiweiß, Soda und doppeltkohlensaurem Natron, zum Saturieren der Runkelrübensäfte in der Zuckerfabrikation, zur Darstellung künstlicher Mineralwässer und andrer moussierender Getränke, wie Schaumwein, Limonade etc., als Feuerlöschmittel etc.
Flüssige K. stellt man aus reiner K. mit Hilfe von Kompressionspumpen dar und bringt sie meist in nahtlosen stählernen (früher in schmiedeeisernen) Flaschen in den Handel. Wegen des großen Ausdehnungskoeffizienten der flüssigen K. dürfen die Flaschen auf 1,34 Lit. Fassungsraum höchstens 1 kg Flüssigkeit enthalten. Die 8 kg-Flaschen enthalten demnach 4360, die 10 kg-Flaschen 5450 Lit. gasförmige K. Sie haben einen Druck von höchstens 50–75 Atmosphären auszuhalten, werden aber auf einen solchen von 250 Atmosphären geprüft. Flüssige K. dient zum Betrieb von Bierdruckapparaten, Dampffeuerspritzen, Motoren, Kälteerzeugungsmaschinen, zur Darstellung künstlicher Mineralwässer und zur Verdichtung von Stahl- und Neusilberguß, zum Abziehen von Bier in Transportfässer, zur Entfernung von Kesselstein, zum Heben gesunkener Schiffe, zu Kältemischungen, zum Anästhesieren, zur Herstellung von Bädern etc. Unter dem Namen Sodor kommen ganz kleine Stahlkapseln in den Handel, die 3–4 g flüssige K. enthalten, so daß eine Kapsel zur Erzeugung einer Flasche moussierenden Getränkes ausreicht. In Deutschland wurden 1884: 122,000, 1889: 1,000,000, 1898: 11,500,000, 1900: 16,000,000 kg flüssige K. produziert, etwa 1/3 in Nord- und Ostdeutschland auf chemischem Weg und 2/3 in West- und Süddeutschland größtenteils aus dort erbohrten natürlichen Quellen (Schwarzwald, Thüringen, Teutoburger Wald, Eifel, Taunus etc.).
K. wurde zuerst im Anfang des 17. Jahrh. durch van Helmont als Gas sylvestre von der gewöhnlichen Luft unterschieden. Hoffmann, der das Gas als Bestandteil der Mineralwässer Spiritus mineralis nannte, bezeichnete es als schwache Säure. Black zeigte, daß K. von den Alkalien gebunden, fixiert wird, und nannte sie fixe Luft; Bergman gab 1774 eine vollständige Geschichte der K., erkannte sie als Bestandteil der Atmosphäre und nannte sie Luftsäure, aber erst Lavoisier erkannte ihre chemische Natur. Flüssige K. wurde 1823 von Davy und Faraday dargestellt und 1844 von Natterer auf mechanischem Wege. Technisch wurde sie zuerst 1876 von Krupp und auf der Torpedostation in New York benutzt. Um 1880 begann die Benutzung der K. zum Ausschenken von Bier und zum Imprägnieren von Wasser und bald darauf in Burgbrohl die Benutzung der aus einer Sprudelquelle aufgefangenen K. Vgl. Luhmann, Die K. (Wien 1885) und Die Fabrikation der flüssigen K. (Berl. 1904); Wender, Die Kohlensäureindustrie (das. 1901); Schleicher, L'acide carbonique liquide (Par. 1901); »Zeitschrift für die gesamte Kohlensäureindustrie« (Berl., seit 1895).
http://www.zeno.org/Meyers-1905. 1905–1909.