- Sauerstoff
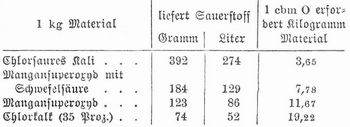
Sauerstoff (Oxygenium) O, chemisch einfacher, gasförmiger Körper, findet sich von allen Elementen am verbreitetsten und in größter Menge auf der Erde, indem die Gesteine, welche die Hauptmasse der Erdrinde bilden, 44–48 Proz. und das Wasser 8852 Proz. S. enthalten. Auch die organische Substanz der Pflanzen und Tiere ist reich an S. Im freien Zustand findet sich S. in der atmosphärischen Luft (23,20 Proz.) und gelöst im Wasser, er wird auch von der lebenden Pflanze im Sonnenlicht ausgehaucht. Ob S. in der Sonne vorkommt, ist fraglich. Neben diesem gewöhnlichen inaktiven S., dessen Molekül aus 2 Atomen besteht (O2), gibt es noch eine Modifikation mit dem Molekulargewicht O3, aktiver S. oder Ozon (s. d.). Neben Ozon wird als »aktiver« S. auch der S. im Entstehungszustand bezeichnet oder chemisch gebundener S., wenn er Oxydationen veranlaßt, die durch gewöhnlichen S. nicht herbeigeführt werden. Zur Darstellung von S. erhitzt man Quecksilberoxyd, Mangansuperoxyd oder chlorsaures Kali, wobei man letzteres vorteilhaft mit etwa dem gleichen Gewicht Braunstein, Kupferoxyd oder gefälltem Eisenoxyd mischt, oder man erhitzt Braunstein mit konzentrierter Schwefelsäure oder saurem schwefelsaurem Natron, wobei schwefelsaures Manganoxydul entsteht. Kaliumbichromat gibt beim Erhitzen mit Schwefelsäure schwefelsaures Chromoxyd, schwefelsaures Kali und S. Leitet man über glühenden Ätzbaryt kohlensäurefreie Luft, so entsteht Baryumsuperoxyd, das bei höherer Temperatur in S. und Baryumoxyd zerfällt. Letzteres wird bei niederer Temperatur durch feuchte Luft wieder oxydiert etc. Eine Mischung von Baryumsuperoxyd und Kaliumbichromat gibt mit verdünnter Schwefelsäure, eine solche von Baryumsuperoxyd und Bleisuperoxyd mit verdünnter Salpetersäure bei gewöhnlicher Temperatur einen gleichmäßigen Strom von S. Ebenso erhält man S. aus Baryumsuperoxyd und Ferricyankalium, aus Natriumsuperoxyd und Wasser, aus Braunstein oder Permanganatlösung und angesäuerter Wasserstoffsuperoxydlösung. Klare konzentrierte Chlorkalklösung gibt, mit einigen Tropfen einer Lösung von Kobaltchlorid oder salpetersaurem Kupfer auf 80° erhitzt, den ganzen Sauerstoffgehalt ab. Man kann auch dicke Kalkmilch mit etwas Kobaltchlorid erhitzen und Chlor einleiten, wobei dann ein Strom S. entweicht. Auch durch elektrolytische Zerlegung des Wassers kann S. (neben Wasserstoff) dargestellt werden. Zur technischen Darstellung von S. sind viele Methoden vorgeschlagen worden. Am zweckmäßigsten erwies sich die oben skizzierte Brinsche Methode mit Baryumoxyd, das im heißen Luftstrom in Baryumsuperoxyd verwandelt wird. Mangansaures Natron zerfällt bei 450° durch Wasserdampf in Manganoxyd, Alkalihydrat und S. Der Rückstand wird durch Überleiten von kohlensäurefreier Luft wieder in mangansaures Natron verwandelt (Tessie du Mothay). Nach Stuart setzt man so viel Ätznatron zu, daß ein unter 400° schmelzendes Gemenge entsteht, und arbeitet in vertikalen Eisenretorten. Kassner zersetzt Calciumplumbat bei 700° durch feuchte Kohlensäure und regeneriert den Rückstand durch Behandeln mit Wasserdampf, dann durch Luft und Wasserdampf. Die technische Darstellung des Sauerstoffs durch Elektrolyse scheint noch nicht in größerm Maßstabe zur Ausführung gelangt zu sein.
Wenn atmosphärische Luft wiederholt durch Kautschukmembran diffundiert, so erhält man zuletzt ein Gasgemisch mit 95 Proz. S. Für praktische Zwecke erfolgt die Diffusion aber viel zu langsam. Preßt man Luft in Wasser, läßt das nicht absorbierte Gas entweichen, entzieht dem Wasser das absorbierte Gas durch eine Pumpe, preßt es abermals in Wasser und wiederholt dies achtmal, so erhält man infolge der Eigenschaft des Wassers, mehr S. zu absorbieren als Stickstoff, zuletzt ein Gas, das nur noch 2,7 Proz. Stickstoff enthält. Noch günstiger gestaltet sich das Verfahren bei Anwendung von glyzerinhaltigem Wasser. Wenn flüssige Luft verdunstet, so entweicht zunächst überwiegend Stickstoff und es bleibt eine Flüssigkeit mit 60–70 Proz. S. zurück; durch weitere fraktionierte Verdampfung läßt sich der S. bis 94 Proz. anreichern (vgl. Luft, flüssige).
S. ist farb-, geruch- und geschmacklos, wird bei -113° unter einem Druck von 50 Atmosphären zu einer schwach bläulichen Flüssigkeit vom spez. Gew. 0,65 bei -119° und von 1,13 bei 182° verdichtet, die bei -182° siedet. Das Atomgewicht ist 16, das spezifische Gewicht des Gases 1,1052, so daß 1 Lit. S. bei 0° und 760 mm Barometerstand 1,429 g wiegt. 1 Volumen Wasser löst bei 0°: 0,041, bei 15°: 0,029 Vol., 1 Vol. Alkohol löst zwischen 0 und 20° konstant 0,28 Vol. S. Bei gewöhnlicher Temperatur ist S. ziemlich indifferent; er verbindet sich aber mit allen Elementen (nicht mit Fluor, Helium, Argon etc.), besonders mit den elektropositivern, und bildet mit denselben (oft in mehreren Verhältnissen) Oxyde, die Basen- oder Säurenanhydride oder indifferente Körper sind. Die Verbindung eines Körpers mit S. (Oxydation, Verbrennung) verläuft oft schnell unter bedeutender Temperaturerhöhung, Erglühen, Flammenbildung, oft langsam ohne bemerkbare Temperaturerhöhung (langsame Verbrennung). Diese letztern Vorgänge spielen in der Natur eine große Rolle. Die Verwesung, das Rosten des Eisens, die Verwitterung mancher Gesteine, der tierische Stoffwechsel sind derartige langsame Verbrennungsprozesse, die zuletzt dieselben Produkte liefern wie die unter Feuererscheinung verlaufende schnelle Oxydation. Bei langsamer Verbrennung angehäufter Massen tritt oft eine allmähliche Temperatursteigerung ein, die bisweilen einen so hohen Grad erreicht, daß plötzlich Entzündung erfolgt und die weitere Oxydation nun unter Flammenbildung schnell verläuft. Hierauf beruht die Selbstentzündung schwefelkiesreicher Kohlen, mit Öl getränkter Putzlappen, großer Heuhaufen etc. In reinem S. verlaufen alle Verbrennungserscheinungen sehr viel lebhafter als in der Luft; ein glimmender Holzspan bricht in reinem S. in Flamme aus, und eine glühende Uhrfeder brennt darin mit lebhaftem Funkensprühen. Leitet man S. in eine Flamme, so verkleinert sie sich und entwickelt nun eine ungemein hohe Temperatur. Eine Mischung von 1 Vol. S. mit 2 Vol. Wasserstoff bildet das Knallgas, das leicht entzündlich ist und unter heftiger Explosion zu Wasser verbrennt. Die mit S. angeblasene Wasserstoffstamme (Knallgasgebläse) entwickelt eine sehr hohe Temperatur. Gewisse Metalle, wie Platin, verdichten besonders im sein verteilten Zustand auf ihrer Oberfläche so viel S., daß, wenn man ein brennbares Gas darauf strömen läßt, eine energische Oxydation eingeleitet wird, bei der sich die Temperatur bis zum Erglühen des Metalls und bis zur Entzündung des Gases steigern kann. S. ist von höchster Bedeutung im Haushalt der Natur: die Existenz der Tierwelt ist an die Gegenwart von S. gebunden, bei Mangel an S. tritt sofort Erstickung ein (daher der Name Lebenslust). Aber während die Tiere S. einatmen und ihn zur Oxydation organischer Substanz verwenden, deren Produkte, Kohlensäure und Wasser, sie ausscheiden, nehmen die Pflanzen Kohlensäure und Wasser auf, reduzieren sie im Sonnenlicht, bilden organische Substanz daraus und atmen überschüssigen S. aus. Abgestorbene organische Stoffe werden durch S. oxydiert (verwesen) und in den Kreislauf der Elemente zurückgeführt. S. tritt gewöhnlich zweiwertig auf, organische Sauerstoffverbindungen aller Art bilden aber mit Säuren, besonders mit komplexen Säuren, Salze, in denen vierwertiger S. als basenbildendes Element angenommen werden muß. Diese Verbindungen sind Salze des Oxoniumhydroxyds OH3.OH (bez. OR3.OH).
Beim Einatmen von reinem S. entsteht ein Gefühl von Leichtsein, die physische Leistungsfähigkeit scheint erhöht, die Respiration wird leichter und freier, die Pulsfrequenz und das Wärmegefühl gesteigert, der Appetit nimmt zu. Bei erhöhter Spannung ist die Einatmung von reinem S. schädlich. Bei einem Druck von 3 Atmosphären sterben Vögel schnell unter Konvulsionen.
Die erleichterte Beschaffung von S. (komprimiert in Bomben) hat dessen Verwendung in der Medizin gefördert. Die Einatmung von reinem S. aus Masken, die Mund und Nase des Kranken bedecken und mittels eines den Zustrom regulierenden Ventils mit dem Sauerstoffbehälter verbunden sind, kann die Atemnot Schwerkranker mildern; namentlich bei Asthma, bei dem Coma der Zuckerkranken, bei Sterbenden zur Linderung des Todeskampfes hat sich diese Methode bewährt. Wichtiger ist, daß die reichliche Zufuhr von reinem S. bei Gasvergiftungen die Rettung von Kranken zu ermöglichen scheint, die bei gewöhnlicher Atmung zugrunde gehen müßten. Bei Leuchtgas-, Kohlenoxyd-, Schwefelwasserstoffvergiftungen kommt das Verfahren zur Anwendung, namentlich ober sind Rettungsgeräte zum Einatmen von S. bei Feuersbrünsten, in Bergwerken, auf Hütten, auch zur Wiederbelebung Erstickter und Ertrunkener mit großem Erfolg angewendet worden. Auch bei der Ausführung der Chloroformnarkose ist S. angewandt worden. Bei Luftschiffahrten nimmt man komprimierten S. mit, um das Gas in bedeutenden Höhen als Belebungsmittel einzuatmen. – Bei Tieren kann man S. ohne Gefahr in großen Mengen in die Blutadern einströmen lassen, ohne daß eine Verstopfung der seinen Gefäße mit Gasblasen eintritt. da der S. sofort vom Blut absorbiert wird; beim Menschen scheint dieses Verfahren (Sauerstoffinfusion) jedoch noch nicht angewendet worden zu sein. S. im Entstehungsmoment benutzt man bei Sarasons Ozetbädern, zu deren Darstellung ein Superoxyd in dem Badewasser gelöst und durch Zusatz einer katalytisch wirkenden Substanz zersetzt wird.
Man bringt komprimierten (100–120 Atmosphären Druck) S. in Stahlzylindern in den Handel, benutzt ihn zur Erzeugung der Knallgasflamme, zum Anblasen der Acetylen- und Leuchtgasflamme, zum Schmelzen des Platins, zum Löten des Bleies, zum Schweißen von Eisen- und Stahlblechen, zum Durchschmelzen eiserner Platten und Blöcke namentlich in Hochöfen, als Enthärtungsmittel gehärteter Panzerplatten, in der Goldarbeiterei, bei der Verarbeitung des Kupfers, in der Glasfabrikation, auch zum Löten von Glas, zum Reinigen von Leuchtgas, zum Entfuseln von Branntwein, zur Beschleunigung des Reisens geistiger Getränke, zur Darstellung von Firnis und in der Bleicherei, zur Erzeugung von Drummondschem Licht, in der Projektionskunst, im Heliographendienst. – Die ältern Chemiker hielten die atmosphärische Luft für eine einfache Substanz, Priestley zeigte 1774, daß sie aus zwei Luftarten besteht, von denen nur eine die Verbrennung und Atmung unterhält, und stellte reinen S. dar. 1775 machte Scheele, unabhängig von Priestley, dieselbe Entdeckung. Sie gab Lavoisier den Schlüssel zu einer richtigen Theorie der Verbrennungserscheinungen, und da die Produkte der Verbrennung in S. häufig saurer Natur sind, so nannte er das Element Säureerzeuger (Oxygéne). Von der Entdeckung des Sauerstoffs datiert die Begründung der neuen Chemie. 1877 wurde S. durch Pictet und Cailletet, später durch Olczewski und Wroblewski verflüssigt. Vgl. Meißner, Untersuchungen über den S. (Hannov. 1863; Neue Untersuchungen, Götting. 1869); Philipps, Der S., Vorkommen, Darstellung und Benutzung zu Beleuchtungszwecken (Berl. 1871); Pictet, Mémoire sur la liquéfaction de l'oxygène (Neuchâtel 1877); Michaelis, Handbuch der Sauerstofftherapie (mit andern, Berl. 1906).
http://www.zeno.org/Meyers-1905. 1905–1909.