- Schwefelsäure
Schwefelsäure (hierzu Tafel »Schwefelsäurefabrikation« mit Text) H2SO4 findet sich im freien Zustand in einigen Gewässern Südamerikas, die auf vulkanischem Gebiet entspringen, z. B. im Rio Vinagre, der täglich 37,600 kg S. liefert, im Schlamm der Vulkane von Guatemala und San Salvador und in einigen Wassern von Tennessee und Louisiana, von denen eins 5,29 g S. in 1 Lit. enthält. Freie S. kommt auch in manchen Gruben wässern und im Sekret der Speicheldrüsen einiger Mollusken, wie Dolium galea, und Tritonium- und Cassis-Arten (2,5–4 Proz.), vor. Sehr weit verbreitet findet sich S. in Form von Schwefelsäuresalzen, besonders als schwefelsaurer Kalk, Anhydrit, Schwerspat, Cölestin, schwefelsaure Magnesia und schwefelsaures Alkali (vgl. Schwefel). Auch in Pflanzen und Tieren sind Schwefelsäuresalze weit verbreitet. S. entsteht bei Oxydation von Schwefel und Schwefliger Säure, beim Lösen von Schwefelsäureanhydrid in Wasser und als Schwefelsäuresalz beim Rösten von Schwefelmetallen. Dargestellt wird S. durch Oxydation von Schwefliger Säure mittels des Sauerstoffes der Luft. Bis 1838 in Europa und bis 1882 in Nordamerika bereitete man die Schweflige Säure in den Schwefelsäurefabriken fast ausschließlich durch Verbrennen von sizilischem Schwefel, jetzt aber benutzt man die Röstgase, die in Hüttenwerken beim Rösten von Kupferkies, Zinkblende, Kupferrohstein, Bleistein etc. aus den Röstöfen entweichen (metallurgische S.), oder man röstet Schwefelkies, der dabei nach der Gleichung 4FeS2+11O2 = 2Fe2O3+8SO2 zersetzt wird. Schweflige Säure oxydiert sich an der Luft langsam, schnell aber, wenn zugleich Wasserdampf und Salpetersäure zugezogen sind, wobei letztere als Sauerstoffüberträger wirkt. Auf 1 Teil verbrannten Schwefel braucht man 2,2–6 Proz. Chilisalpeter.
Die aus den Rostöfen (s. Tafel, S. I, Fig. 1–4) entweichenden Gase enthalten etwa 8 Volumprozent Schweflige Säure und besitzen eine Temperatur von ca. 300°. Sie werden in den Gloverturm (s. unten) geleitet und gelangen aus diesem zur Oxydation der Schwefligen Säure in die Bleikammern. Der Gloverturm besteht wie die Bleikammern aus einem äußern Gerüst, das innen mit Bleiplatten, die mit Hilfe des Knallgasgebläses zusammengelötet wurden, ausgekleidet ist. Er ist im Innern mit säurefesten Steinen ausgekleidet und mit Quarzsteinen oder Koks gefüllt, durch die herabrieselnde Flüssigkeit (s. unten) sein verteilt wird, so daß sie den von unten entgegenströmenden Gasen eine große Oberfläche darbietet. Die Bleikammern sind ebenfalls aus Bleiplatten zusammengesetzt. Auf 1 kg Pyrit, der in 24 Stunden abgeröstet wird, rechnet man 0,5 cbm Kammerraum, und als mittelgroße Kammersysteme betrachtet man solche von 4000 cbm. Die Gase, die auseinander einwirken sollen, eingeleitete Luft und die Röstgase, durchströmen die Kammern von der einen Schmalseite zur andern, und gewöhnlich sind 3–4 Kammern zu einem System vereinigt und durch weite Bleiröhren miteinander verbunden. Die zur Oxydation der Schwefligen Säure bestimmte Salpetersäure wird aus Chilisalpeter und S. in einer besondern Abteilung der Röstöfen entwickelt. Man stellt aber auch in der Bleikammer flache irdene Schalen mit breitem Überlaufschnabel treppenartig zu einem Kaskadenapparat zusammen und läßt Salpetersäure langsam durch alle Schalen strömen, so daß sie der Schwefligen Säure eine große Oberfläche darbietet. Gegenwärtig leitet man gewöhnlich die Salpetersäure zusammen mit der Nitrose in den Gloverturm. Den zur Bildung der S. erforderlichen Wasserdampf leitet man aus einem Dampfkessel in der Richtung der Strömung der Gase in die Bleikammern. Zur Erzeugung des Zuges in den Bleikammern schaltet man hinter dem Gloverturm und vor dem Gay-Lussac-Turm Ventilatoren ein. Die Temperatur beträgt in der ersten Kammer etwa 54°, in der dritten etwa 30°. Um Verlust an Salpetersäure zu vermeiden, muß der aus der letzten Kammer austretende Luftstickstoff (der noch 6 Proz. Sauerstoff enthält) durch einen Gehalt an Zersetzungsprodukten der Salpetersäure rot gefärbt sein; er wird zur Gewinnung dieser Produkte in den Gay-Lussac-Turm (Tafel, S. II, Fig. 5) geleitet, in dem jene von herabrieselnder konzentrierter S. aufgenommen werden. Die aus dem Gay-Lussac-Turm abfließende Nitrose (nitrose Säure) leitet man mit der am Boden der Kammern angesammelten verdünnten S. (Kammersäure) mit 62–70 Proz. H2SO4 in den Gloverturm, wo sie durch die ent gegenströmenden heißen Röstgase konzentriert und von den nitrosen Dämpfen, die wieder in die Kammern strömen, befreit, denitriert wird.
Der in den Kammern verlaufende chemische Prozeß ist nicht mit voller Sicherheit bekannt. Nach Lunge dient Salpetrige Säure HNO2 oder (im vordern Teil des Kammerstmems) Stickstoffoxyd NO als Überträger von atmosphärischem Sauerstoff und Wasser auf Schwefeldioxnd und als Zwischenprodukt tritt Nitrosulfonsäure (Nitrosylschwefelsäure) NO2SO3H auf. Man hat dann folgende Gleichungen
2SO2+2HNO2+O2 = 2NO2.SO3H
NO2.SO3H+H2O = H2SO4+HNO2
Fehlt es in den Kammern an Wasser (s. zweite Gleichung), dann entstehen die Bleikammerkristalle, deren Zusammensetzung der Formel NO2.SO3H entspricht. Auch im Gloverturm wird S. gebildet, und man erspart durch ihn ganz erheblich Brennmaterial, das sonst zum Konzentrieren der Säure verbraucht wurde. In den besten Fabriken verwandelt man 95 Proz. des in den Pyriten enthaltenen Schwefels in S., der Rest des Schwefels bleibt teils in den Abbränden, teils ist er Fabrikationsverlust.
Die etwa 60 proz. Kammersäure (50–55° B.) kann für manche Zwecke direkt benutzt werden, der Gloverturm liefert S. von 60–62° B.; wo aber ein solcher Turm nicht vorhanden ist und stärkere Säure dargestellt werden soll, verdampft man die Kammersäure in Bleipfannen oder gußeisernen Kesseln, auch in mit Blei ausgeschlagenen Holzkasten oder in Steingefäßen mit gespanntem Dampf bis 60 oder 62° B. (80 proz. Pfannensäure). Bei weitem der größte Teil der S. wird in dieser Konzentration (zur Soda- und Superphosphatfabrikation) verbraucht. Für den Handel aber stellt man 90 proz. S. (englische S. von 66, oft nur 65° B.) dar, die vor der Konzentrierung gereinigt wird. Die rohe Säure enthält als Verunreinigungen hauptsächlich Arsen, Selen, Eisen, Blei, auch Antimon, Thallium, Zink, Kupfer, Quecksilber, Kalk etc., Salpeter und Salpetrige Säure, Schweflige Säure. Zur Reinigung dienen verschiedene Vorrichtungen zum Auffangen von Flugstaub und zur Befreiung der Kammersäure von mechanischen Verunreinigungen. Zur Reinigung von Arsen verdünnt man die Gloversäure auf 46–50° (wobei der größte Teil des gelösten Bleies sich ausscheidet) oder benutzt unverdünnte Kammersäure und fällt daraus das Arsen durch Schwefelwasserstoff als Schwefelarsen, wobei zugleich das Selen abgeschieden wird. Eine vollständige Fällung des Arsens gelingt nicht, und deshalb muß S., die absolut arsenfrei sein soll, aus Schwefel (nicht aus Pyrit) dargestellt werden. Die Stickstoffverbindungen entfernt man durch Ausstreuen von schwefelsaurem Ammoniak auf die heiße Säure in den Eindampfpfannen. Die gereinigte Säure wird in Bleipfannen auf 60° B. und dann in geschlossenen Kesseln aus Platin, die zweckmäßig innen mit Gold plattiert sind, auch in Kesseln aus Platingoldlegierungen auf 66° verdampft.
Der Verdampfapparat von Faure u. Keßler besteht aus zwei Platinpfannen. Die Säure von 63° B. fließt in die erste große Schale von 90 cm Durchmesser und gelangt dann durch ein Überlaufrohr in die etwas tiefer stehende zweite kleinere Pfanne. Jede Pfanne hängt in einem eisernen Ringe, so daß der ganze Boden dem Feuer ausgesetzt ist. Die Feuerung liegt unter der kleinen Pfanne, von wo aus auch die größere geheizt wird. Jede Platinschale hat einen erhöhten Rand und besitzt dort eine ringförmige Rinne zur Aufnahme des Domes. Dieser ist aus Blei hergestellt und doppelwandig, um durch kaltes Wasser gekühlt werden zu können. Der Dom hängt in einem sechsbeinigen schmiedeeisernen Gerüst, so daß sein unterer Rand in die Platinrinne hineinragt, ohne darin aufzuliegen. Die im Dom verdichtete und an der Innenwand herabfließende Säure stellt in der Rinne einen hydraulischen Verschluß her, aus dem die Säure beständig abgezogen wird. Der Dom hat oben eine Öffnung, die von dem Ableitungsrohr für die nicht verdichteten Dämpfe unter hydraulischem Verschluß umklammert wird. Dieses Rohr mündet nach zweimaliger Biegung in einen flachen Kasten, auf dessen Boden es mit seinem hoch krenelierten Rande steht, so daß bei vermindertem Druck Luft eintreten kann. Die hinreichend konzentrierte heiße Säure fließt aus der zweiten Schale durch ein Platinrohr mit Sicherheitstrichter für den Dampfauslaß in eine Porzellanschale, die am Boden eines mit Säure gefüllten Gefäßes steht. Die Säure wird durch eine Kühlschlange gekühlt, und die aufsteigende Säure gelangt in einen von beiden Seiten durch Wasser gekühlten Mantel und aus diesem direkt in die Ballons. Über das Verdampfen mit heißer Luft s. Tafel, S. II.
Die großen Kosten des Bleikammerbetriebes führten zu vielen Vorschlägen, den Kammerraum zu vermindern oder die Kammer durch billigere Apparate zu ersetzen. Dahin gehören die Vorschläge, statt Luft reinen Sauerstoff in die Kammern einzuführen oder sehr viel Salpeter anzuwenden (Intensivbetrieb), namentlich aber für eine bessere Mischung der Gase Sorge zu tragen. Den größten Erfolg hatten Misch- und Kühltürme (Zwischentürme, Reaktionstürme) zwischen den Kammern, wobei schließlich die eigentlichen Bleikammern fortgelassen wurden und man sich mit einer kleinen Kammer vor und einer ebensolchen hinter dem Turm begnügte; auch hat man sich bemüht, die Bleikammern völlig zu beseitigen und nur mit Türmen zu arbeiten. Da es sich nicht um einfaches Gemisch von Gasen und Dämpfen, sondern um aus Flüssigkeitströpfchen gebildeten Nebel handelt, so müssen die Türme diesem Gemisch große feste Oberflächen darbieten, um die Flüssigkeitströpfchen zu dünnen Schichten zu verschmelzen, in denen die Reaktionen schnell verlaufen. Von diesen Apparaten haben die Plattentürme von Lunge u. Rohrmann, Guttmanns Kugelturm und Bettenhauser Kegeltürme große Verbreitung gefunden.
Die konzentrierte S. des Handels ist oft durch hineingefallenen und zum Teil verkohlten Staub mehr oder weniger braun gefärbt; sie enthält, wenn sie in Bleipfannen sehr stark verdampft wurde, etwas schwefelsaures Blei, das. sich beim Verdünnen abscheidet, oft auch Salpetersäure oder andre Oxyde des Stickstoffs und Arsen. Reine S. erhält man durch Gefrierenlassen möglichst reiner konzentriert er S. Auf Zusatz einiger Kristalle von H2SO4 kristallisiert die größere Menge der vorhandenen H2SO4 aus und kann durch Ausschleudern bei 0° von der Muttersäure getrennt werden.
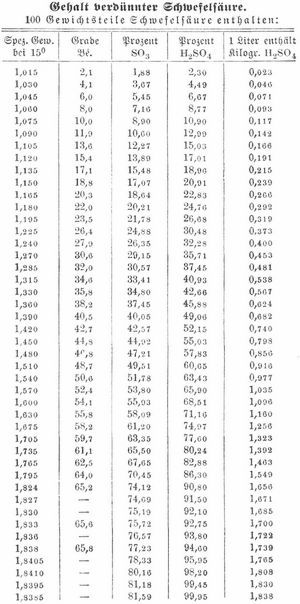
Die Kristalle schmelzen bei 10,5°, und die so erhaltene Säure kommt als S. von 99,5 Proz. in den Handel. Chemisch reine S. kann nur durch fraktionierte Destillation technisch reiner Säure aus Glasretorten erhalten werden. Über die Herstellung von S. nach dem Kontaktverfahrens. Schwefelsäureanhydrid. Das Acidum sulfuricum des Deutschen Arzneibuches hat das spez. Gew. 1,836–1,840, es gibt, mit 5 Teilen Wasser gemischt, das A. s. dilutum (verdünnte S.). Reine S. H2SO4 (früher Schwefelsäuremonohydrat genannt) ist farb- und geruchlos, fließt wie Öl, raucht an der Luft erst bei 30–40°, zischt nicht beim Eingießen in Wasser und wirkt höchst ätzend. Sie besitzt das spez. Gew. 1,850 bei 15°, siedet bei 338°, erstarrt in der Kälte, wenn man einen Kristall von H2SO4 hineinbringt, und schmilzt dann bei 10°; beim Sieden findet partielle Zersetzung statt, es entweicht etwas Schwefelsäureanhydrid, und es destilliert eine Säure mit 98,7 Proz. H2SO4. S. zieht aus der Luft begierig Wasser an und entwickelt beim Verdünnen mit Wasser viel Wärme. Dabei findet eine Kontraktion statt (50 Vol. S. und 50 Vol. Wasser geben nach der Abkühlung 97,1 Vol.). Man muß stets, wenn man S. mit Wasser mischen will, die Säure vorsichtig und unter Umrühren in das Wasser gießen, niemals umgekehrt, weil sonst durch plötzliche Dampfbildung die Säure umhergeschleudert werden würde. Viele Beobachtungen weisen darauf hin, daß S. mit Wasser mehrere Hydrate bildet, in denen das Wasser nach festem Verhältnis mit der Säure verbunden ist. Den Gehalt verdünnter S. von verschiedenem spezifischen Gewicht zeigt die Tabelle auf S. 161.
S. ist eine starke Säure; sie reagiert noch bei tausendfacher Verdünnung sauer, sie neutralisiert die stärksten Basen vollständig und bildet zwei Reihen Salze; sie treibt die andern Säuren aus ihren Verbindungen aus und wird selbst regelmäßig nur durch nicht flüchtige Säuren in hoher Temperatur deplaciert. Sie löst die meisten Metalle entweder (Eisen, Zink etc.) als verdünnte Säure unter Entwickelung von Wasserstoff oder (Kupfer, Silber, Quecksilber) als konzentrierte Säure unter teilweiser Reduktion zu Schwefliger Säure. Platin wird von konzentrierter S. nicht angegriffen, Gußeisen widersteht einer Säure von höherm spezifischen Gewicht als 1,65 in der Wärme und in der Kälte sehr gut, und Blei wird nur von Säure angegriffen, die ein höheres spezifisches Gewicht besitzt als 1,71. Durch Kohle, Schwefel, Phosphor und bei 160° durch Wasserstoff wird sie zu Schwefliger Säure reduziert. Mit wenig Wasser versetzte konzentrierte S. wird auf Zugabe von Zink durch den Wasserstoff im Entstehungsmoment zu Schwefelwasserstoff reduziert. In glühenden Röhren zerfällt der Dampf von S. in Schweflige Säure, Sauerstoff und Wasser. Organischen Stoffen entzieht S. die Elemente des Wassers, oft unter tiefgreifender Zersetzung, Verkohlung, Entwickelung von Kohlenoxyd, Kohlensäure, Schwefliger Säure. Alkohol wird durch S. in Äthylen und Wasser zerlegt, und bei Einwirkung minder konzentrierter Säure entsteht Äther; Glykoside werden durch sie gespalten, Fette in Glyzerin und fette Säuren zerlegt, Papier wird von konzentrierter S. bei kurzer Einwirkung in Pergamentpapier umgewandelt, Zellulose und Stärkemehl bei längerer Einwirkung verdünnter S. in Dextrin und Zucker übergeführt etc.
S. löst Schwefelsäureanhydrid in jedem Verhältnis. Dabei bilden sich mehrere durch ihre Schmelzpunkte unterscheidbare Verbindungen. Gleiche Moleküle S. und Anhydrid geben Pyroschwefelsäure (Dischwefelsäure) H2S2O7, die in großen Prismen kristallisiert und bei 35° schmilzt. Eine Mischung von S. mit Anhydrid nach schwankenden Verhältnissen (meist mit 10–20 Proz. Anhydrid) ist die rauchende S. (Nordhäuser Vitriölöt, Oleum). Diese wird dargestellt, indem man Vitriolschiefer (schwefelkieshaltigen Tonschiefer) an der Luft stark verwittern läßt, dann auslaugt, die Lauge, die schwefelsaures Eisenoxydul und schwefelsaures Eisenoxyd enthält, verdampft, den Rückstand (Rohstein) kalziniert, um den Eisenvitriol möglichst in schwefelsaures Eisenoxyd überzuführen, und in kleinen irdenen Kolben im Galeerenofen mit irdenen Vorlagen erhitzt. Das schwefelsaure Eisenoxyd zerfällt hierbei in Eisenoxyd (Totenkopf, Caput mortuum) und in Schwefelsäureanhydrid, das sich in der konzentrierten S. löst, mit der man die Vorlagen beschickt hatte. Rauchende S. ist dickflüssiger als gewöhnliche, sie zischt, wenn man sie in Wasser gießt, raucht stark an der Luft, beginnt bei 40–50° zu sieden, liefert Schwefelsäureanhydrid als Destillat und hinterläßt eine Säure von der Konzentration der gewöhnlichen S. Beim Abkühlen unter 0° scheiden sich aus rauchender S. Kristalle von Pyroschwefelsäure H2S2O7 aus. Seit der Ausbildung des Kontaktverfahrens (s. Schwefelsäureanhydrid) kommt nach diesem Verfahren hergestelltes Oleum mit dem verschiedensten Gehalt an Anhydrid in den Handel.
Verwendung. S. von 60–62° B., die Form, in der die bei weitem größte Menge aller erzeugten S. verbraucht wird, dient zur Darstellung von Natriumsulfat, Soda und Pottasche (Salzsäure, Chlorkalk etc.), Salpetersäure, Schwefliger Säure, Phosphorsäure, Chromsäure, Kohlensäure, Oxalsäure und andrer Säuren, Superphosphat, Phosphor, Jod, Brom, Chlor, zur Abscheidung von Baryt, Strontian, Kalk bei vielen Prozessen, zur Darstellung von Alaun, Eisen-, Kupfervitriol und andern Sulfaten, Kaliumchromat in der Metallurgie und zur Darstellung vieler Metallsalze, beim Verzinnen und Verzinken von Eisenblech, zum Vergolden, Versilbern, zu galvanischen Elementen, zur Darstellung von Wasserstoff und Wasserstoffsuperoxyd, Äthern und Estern, organischen Farbstoffen, Mineral olen, Paraffin, zum Raffinieren des Rüböls, zur Darstellung von Pergamentpapier, Stärkesirup, Stärkezucker, zur Verzuckerung von Getreide, zur Tilgung alkalischer Reaktion bei der Melassenbrennerei und Preßhefenfabrikation, zur Zerstörung von Pflanzenfasern in gemischten Lumpen, zum Entfetten der Wolle etc. Konzentrierte S. dient zur Darstellung von Schießbaumwolle, Nitroglyzerin, Pikrinsäure, Nitrobenzol, Nitronaphthalin etc., zur Reinigung des Erdöls und der Mineralöle, zur Darstellung von Sauerstoff, zum Trocknen von Luft und andern Gasen (Chlor), zum Affinieren von Gold und Silber, zur Darstellung von Sulfosäuren, besonders der Teerfarbstoffe. Rauchende S. dient zum Lösen des Indigo, zur Darstellung von Alizarin, Resorzin, Sulfonsäuren, zur Reinigung von Ozokerit, zur Füllung von Akkumulatoren. In der Medizin gibt man S. bei entzündlichen fieberhaften Krankheiten, Lungenleiden, Herzklopfen, Hautkrankheiten etc. Vielfach kommen Vergiftungsfälle mit konzentrierter S. vor (vgl. Schwefelsäurevergiftung).
Geschichtliche s. S. dürfte schon den Alten bekannt gewesen sein und wurde von Geber durch Destillation von Alaun oder Eisenvitriol (daher Vitriolgeist) erhalten. Basilius Valentinus stellte sie durch Verbrennen von Schwefel mit Salpeter dar, und Libavius bewies 1595 die Identität dieser Säure mit dem Vitriolgeist. Angelus Sala lehrte 1613 die Darstellung von S. durch Verbrennen von Schwefel in feuchten Gefäßen bei Überschuß von Luft, und Lefèvre und Lémery wandten hierbei Salpeter an. Hierauf begründete sich die fabrikmäßige Darstellung. die auf Cornelius Drebbel zurückzuführen sein soll. Sicher ist, daß Ward um 1740 in Richmond bei London S. nach dieser Methode fabrizierte. 1746 wandte Roebuck in Birmingham Bleikasten an, in denen er ein Gemisch von Schwefel und Salpeter verbrannte. 1766 erbaute Holker die erste Fabrik in Rouen. 1793 zeigten Clément und Desormes, daß die Bleikammern durch einen kontinuierlichen Luftstrom gespeist werden können, und daß der Salpeter nur die Rolle eines Vermittlers zwischen Schwefliger Säure und Luftsauerstoff spielt. Die jetzt gebräuchliche kontinuierliche Schwefelverbrennung mit Anwendung mehrerer Bleikammern wurde zuerst 1807 in St. Rollox bei Glasgow ausgeführt. In Deutschland entstand die erste Schwefelsäurefabrik mit Bleikammern 1820 in Ringkuhl bei Kassel und eine zweite in Potschappel bei Dresden. 1827 konstruierte Gay-Lussac seinen Kondensationsturm, der aber erst 1835 zu praktischer Anwendung gelangte, und empfahl die Benutzung von Salpetersäure statt des Salpeters. Die Benutzung der Pyrite versuchte zuerst Hill in England 1818, Perret und Sohn verwerteten seit 1832 die beim Rösten kupferhaltiger Kiese auftretende Schweflige Säure zur Darstellung von S., 1837 wurden auch in Böhmen Kiese angewandt, 1839 in England und seit 1840 in Deutschland. Die Anwendung des von Glover konstruierten Turmes datiert von 1859. In Deutschland wurde der erste Gay-Lussacsche Turm 1865 in Freiberg erbaut, und die Glovertürme fanden Ende der 1870er Jahre Eingang. Die Darstellung der rauchenden S., seit dem 16. Jahrh. in Böhmen, Sachsen und am Harz üblich und hauptsächlich in der Nähe von Nordhausen ausgeführt, ging in neuerer Zeit fast ausschließlich in die Hände der Firma Starck in Böhmen über. Das Kontaktverfahren, 1831 durch Phillips entdeckt und 1875 durch Winkler begründet, gewann schnell an Bedeutung, seitdem durch die Herstellung von Alizarin und andern Teerfarbstoffen der Bedarf an rauchender S. stark gewachsen war. Durch zahlreiche Entdeckungen von Knietsch (Badische Anilin- und Sodafabrik) wurde es zuerst für praktischen Betrieb geeignet gemacht und ausgeführt. 1892 betrug die Schwefelsäureproduktion in Deutschland 496,400 Ton., davon aus deutschem, französischem und italienischem Kies 139,080, aus spanischem und portugiesischem Kies 248,300, aus ungarischem und norwegischem Kies 7020, aus Zinkblende 62,000, aus gemischten Erzen 33,000, aus Schwefel und Gasreinigungsmasse 7000 T. Die Statistik der Schwefelsäureproduktion ist sehr unzuverlässig, weil Angaben über die Stärke der hergestellten Säure überall fehlen Sieht man hiervon ab, so läßt sich die Gesamtproduktion für 1905 auf 4 Mill. T. schätzen. Davon entfallen auf England 1,1 Mill., Deutschland 900,000, Vereinigte Staaten 850,000, Frankreich 500,000, Italien 200,000, Österreich 200,000, Belgien 165,000, Rußland 125,000, Japan 50,000 T. Deutschland führte 1905 an S. 338,370 dz ein und 487,006 dz aus. Vgl. Smith, Chemie der Schwefelsäurefabrikation (deutsch von Bode, Freiberg 1874); Bode, Beiträge zur Theorie und Praxis der Schwefelsäurefabrikation (Berl. 1872); Lunge, Handbuch der Schwefelsäurefabrikation (3. Aufl., Braunschw. 1903); Jurisch, Handbuch der Schwefelsäurefabrikation (Stuttg. 1893); Mierzinski, Praxis und Betriebskontrolle der Schwefelsäurefabrikation (Wien 1904).
http://www.zeno.org/Meyers-1905. 1905–1909.